¿Dónde se ve la energía de ionización? Descubre su importancia y aplicaciones


La energía de ionización es un concepto fundamental en el campo de la química y la física atómica, esencial para comprender cómo los átomos interactúan con su entorno. Este fenómeno se refiere a la cantidad de energía necesaria para extraer un electrón de un átomo o ion en estado gaseoso. Su importancia radica en múltiples aplicaciones prácticas y su influencia en propiedades químicas.
En el ámbito científico, la energía de ionización no solo ayuda a predecir la reactividad de los elementos, sino que también es crucial en la formación de enlaces químicos. Por ejemplo, el análisis de esta energía es vital para entender por qué los metales alcalinos son tan reactivos o por qué los gases nobles tienden a ser inertes. Estas propiedades tienen implicaciones directas en la industria y la investigación.
¿Te has preguntado alguna vez cómo los científicos determinan qué elementos son más propensos a participar en reacciones químicas? La energía de ionización proporciona una clave esencial en esta búsqueda. A lo largo de este texto, exploraremos sus aplicaciones en campos tan diversos como la electrónica y la astronomía, destacando su papel en el desarrollo tecnológico y científico.
¿Qué es la energía de ionización?


La energía de ionización es la cantidad mínima de energía necesaria para remover un electrón de un átomo o ion en su estado gaseoso. Este concepto es fundamental en la química y la física, ya que está directamente relacionado con la reactividad de los elementos y su capacidad para formar enlaces químicos. La energía de ionización varía entre los diferentes elementos de la tabla periódica y se ve influenciada por factores como la carga nuclear y la distancia entre el núcleo y los electrones.
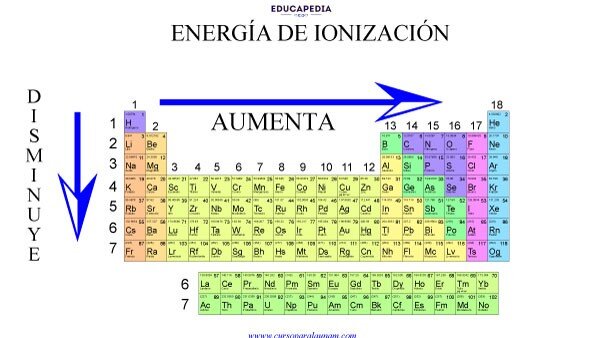
Articulos de Interés:La Importancia del Litio en la Industria: Clave para el Futuro SostenibleEn términos generales, los elementos que se encuentran en la parte superior derecha de la tabla periódica, como los gases nobles, suelen tener una alta energía de ionización. Esto se debe a que sus electrones están más fuertemente atraídos por el núcleo, lo que dificulta su eliminación. Por otro lado, los metales alcalinos, que se encuentran en la parte inferior izquierda, tienen una energía de ionización más baja, lo que facilita la pérdida de electrones y, por ende, su reactividad.
Factores que afectan la energía de ionización
La energía de ionización no es una constante; varía dependiendo de varios factores. Algunos de los principales son:
- Carga nuclear efectiva: A medida que aumenta la carga del núcleo, la energía de ionización también tiende a aumentar.
- Configuración electrónica: Los electrones en capas más externas experimentan menos atracción del núcleo, lo que reduce la energía de ionización.
- Repulsión entre electrones: Los electrones en la misma capa pueden repelerse entre sí, afectando la energía necesaria para remover uno de ellos.
- Estado del átomo: La energía de ionización de un ion ya cargado es diferente de la de un átomo neutro.
- Interacción con otros átomos: En un entorno químico, la presencia de otros átomos o moléculas puede influir en la energía de ionización.
La comprensión de la energía de ionización es esencial para predecir el comportamiento químico de los elementos. Por ejemplo, al conocer la energía de ionización de un elemento, los químicos pueden anticipar su tendencia a formar enlaces y su reactividad en diferentes condiciones. Este conocimiento es aplicable en diversas áreas, desde la química orgánica hasta la bioquímica, donde las interacciones atómicas son cruciales para la formación de compuestos y estructuras biológicas.
Factores que influyen en la energía de ionización
La energía de ionización es la cantidad de energía necesaria para eliminar un electrón de un átomo o ion en estado gaseoso. Este fenómeno es fundamental en la química, ya que afecta la reactividad de los elementos y la formación de enlaces químicos. Existen varios factores que influyen en la energía de ionización, los cuales se pueden clasificar en características atómicas y efectos del entorno.
Uno de los factores más relevantes es el tamaño del átomo. A medida que se desciende en un grupo de la tabla periódica, los átomos aumentan de tamaño debido a la adición de capas electrónicas. Esto provoca que los electrones más externos estén más alejados del núcleo, lo que reduce la atracción electrostática entre el núcleo positivo y los electrones. Como resultado, la energía de ionización disminuye en estos casos. Por el contrario, en los períodos, la energía de ionización tiende a aumentar de izquierda a derecha, ya que el aumento de la carga nuclear efectiva atrae más fuertemente a los electrones.
Articulos de Interés:El color que no refleja el sol: descubre el misterio detrás de su invisibilidadConfiguración electrónica
La configuración electrónica de un elemento también juega un papel crucial en la energía de ionización. Los átomos con una configuración electrónica estable, como los gases nobles, presentan energías de ionización significativamente más altas. Esto se debe a que los electrones en estos átomos están organizados de tal manera que requieren más energía para ser removidos. Por otro lado, los elementos que tienen electrones en capas externas incompletas suelen tener energías de ionización más bajas, lo que los hace más reactivos.
Además, la carga nuclear efectiva es un factor determinante. Esta se refiere a la atracción neta que sienten los electrones por el núcleo, teniendo en cuenta la repulsión entre electrones. A medida que aumenta la carga nuclear efectiva, la energía de ionización también tiende a aumentar, ya que los electrones son retenidos con más fuerza. Por lo tanto, la posición de un elemento en la tabla periódica, junto con su configuración electrónica, influye directamente en la energía de ionización.
Finalmente, el entorno químico también puede afectar la energía de ionización. Factores como la presencia de otros átomos o moléculas pueden alterar la energía necesaria para ionizar un átomo. Por ejemplo, en compuestos iónicos, la interacción con otros iones puede facilitar o dificultar la eliminación de electrones, modificando así la energía de ionización en comparación con el estado gaseoso.
Ejemplos de elementos con alta y baja energía de ionización
La energía de ionización es la cantidad de energía necesaria para remover un electrón de un átomo en estado gaseoso. Este concepto es fundamental en la química, ya que influye en la reactividad y propiedades de los elementos. En este artículo, exploraremos ejemplos de elementos que exhiben alta y baja energía de ionización, destacando sus características y aplicaciones.
Los elementos con alta energía de ionización suelen encontrarse en la parte superior derecha de la tabla periódica. Por ejemplo, el helio (He) y el neón (Ne) son gases nobles que poseen una energía de ionización notablemente alta. Esto se debe a su configuración electrónica completa, lo que los hace muy estables y poco reactivos. Otros elementos como el oxígeno (O) y el flúor (F) también presentan alta energía de ionización, lo que contribuye a su tendencia a formar enlaces covalentes fuertes.
Articulos de Interés:Ciclo de la Materia y Flujo de Energía: Claves para entender los procesos naturalesElementos con baja energía de ionización
Por otro lado, los elementos que presentan baja energía de ionización se encuentran generalmente en la parte inferior izquierda de la tabla periódica. Un ejemplo destacado es el cesio (Cs), que tiene una de las energías de ionización más bajas. Esto lo convierte en un metal altamente reactivo, que puede perder su electrón de valencia con facilidad. Otros metales alcalinos, como el potasio (K) y el sodio (Na), también muestran características similares, facilitando reacciones químicas en diversas condiciones.
Además, los metales de transición, como el cobre (Cu) y el hierro (Fe), presentan energías de ionización intermedias, lo que les permite participar en una variedad de reacciones redox y formar compuestos complejos. Estos elementos son cruciales en aplicaciones industriales y biológicas, donde su capacidad para perder o ganar electrones es fundamental.
Comparación y aplicaciones
En esencia, la energía de ionización es un factor clave para entender la química de los elementos. Los elementos con alta energía de ionización tienden a ser más estables y menos reactivos, mientras que aquellos con baja energía de ionización son más propensos a participar en reacciones químicas. Esta diferencia es esencial en campos como la química inorgánica, la biología y la ingeniería de materiales, donde la reactividad de los elementos influye en el diseño de nuevos compuestos y en el desarrollo de tecnologías innovadoras.
¿Cómo se mide la energía de ionización?
La energía de ionización es la cantidad de energía necesaria para remover un electrón de un átomo o ion en estado gaseoso. Este proceso es fundamental en la química, ya que ayuda a entender la reactividad de los elementos y su comportamiento en diferentes condiciones. La medición de la energía de ionización se realiza comúnmente a través de dos métodos principales: espectroscopia de fotoelectrones y métodos térmicos.
Espectroscopia de fotoelectrones
La espectroscopia de fotoelectrones es una técnica que permite medir la energía de ionización mediante la interacción de fotones con los electrones de un átomo. En este método, se expone el átomo a una fuente de radiación electromagnética, generalmente luz ultravioleta o rayos X. Los electrones son expulsados del átomo y su energía cinética se mide. La relación entre la energía del fotón incidente y la energía cinética del electrón eyectado permite calcular la energía de ionización del átomo.
Este método es muy preciso y se utiliza para determinar las energías de ionización de elementos en estado gaseoso, proporcionando información valiosa sobre la estructura electrónica de los átomos. Además, se puede aplicar a diferentes tipos de átomos y moléculas, haciendo de esta técnica una herramienta versátil en el estudio de la química.
Métodos térmicos
Otro enfoque para medir la energía de ionización es a través de métodos térmicos. En este caso, se analizan los cambios en la energía térmica de un sistema cuando un electrón es removido de un átomo. Este método es menos directo que la espectroscopia de fotoelectrones, pero puede ser útil en ciertas condiciones experimentales, especialmente cuando se estudian moléculas complejas o en estado sólido.
Los métodos térmicos pueden incluir técnicas como la termodinámica de equilibrio y la medición de calor específico. Estos enfoques permiten estimar la energía de ionización a partir de la variación de energía en reacciones químicas, ofreciendo una visión complementaria a la obtenida por espectroscopia.
En esencia, la energía de ionización se mide principalmente a través de espectroscopia de fotoelectrones y métodos térmicos. Cada técnica aporta una perspectiva única sobre la naturaleza de los electrones en los átomos, permitiendo a los científicos profundizar en la comprensión de la estructura atómica y la química en general.
Importancia de la energía de ionización en la química

La energía de ionización es un concepto fundamental en la química que se refiere a la cantidad de energía necesaria para remover un electrón de un átomo o ion en su estado gaseoso. Este parámetro no solo es crucial para entender la reactividad química de los elementos, sino que también influye en diversas propiedades físicas y químicas. La energía de ionización permite predecir cómo los átomos interactuarán entre sí, lo que es esencial para el estudio de enlaces químicos y la formación de compuestos.
Uno de los aspectos más relevantes de la energía de ionización es su relación con la estructura electrónica de los átomos. Los elementos en la misma columna de la tabla periódica, conocidos como grupos, presentan tendencias similares en sus energías de ionización. Por ejemplo, los metales alcalinos tienen energías de ionización más bajas en comparación con los gases nobles, lo que explica su alta reactividad. Esta tendencia se debe a que los electrones de valencia en los metales alcalinos están más alejados del núcleo, lo que facilita su eliminación.
Impacto en la reactividad química
La energía de ionización también juega un papel crucial en la reactividad química de los elementos. Un átomo con una energía de ionización baja tiende a perder electrones con mayor facilidad, lo que lo convierte en un buen agente reductor. Por otro lado, los átomos con alta energía de ionización son más propensos a atraer electrones, actuando como agentes oxidantes. Este equilibrio entre la pérdida y ganancia de electrones es esencial para la formación de compuestos químicos y reacciones redox.
Además, la energía de ionización está relacionada con otros conceptos químicos importantes, como la electronegatividad y la afinidad electrónica. Comprender estas relaciones permite a los químicos predecir comportamientos en reacciones químicas, facilitando la síntesis de nuevos materiales y compuestos. La capacidad de manipular la energía de ionización abre la puerta a aplicaciones en diversas áreas, desde la farmacología hasta la ingeniería de materiales.
Relevancia en aplicaciones prácticas
La energía de ionización no solo es un concepto teórico; tiene aplicaciones prácticas significativas. En la industria química, por ejemplo, la manipulación de la energía de ionización es fundamental para el diseño de catalizadores y la optimización de procesos de reacción. También es esencial en la biología, donde la transferencia de electrones entre biomoléculas es clave para procesos metabólicos. Por lo tanto, entender la energía de ionización es crucial para avanzar en la investigación y el desarrollo de nuevas tecnologías.
Conclusión
La energía de ionización es un concepto fundamental en la química y la física, que nos permite comprender la reactividad y las propiedades de los elementos. A lo largo de este artículo, hemos explorado cómo esta energía se manifiesta en diferentes contextos, desde la estructura atómica hasta su influencia en las reacciones químicas. Conocer la energía de ionización de un elemento nos ayuda a predecir su comportamiento, lo que es crucial en campos como la investigación de nuevos materiales y la química ambiental.
Además de su importancia teórica, la energía de ionización tiene aplicaciones prácticas que impactan nuestra vida diaria. Por ejemplo, se utiliza en el diseño de semiconductores y en la producción de energía limpia a través de celdas de combustible. Estas aplicaciones no solo destacan la relevancia de este concepto, sino que también subrayan el papel esencial que juega en el avance tecnológico. Continuar explorando estas aplicaciones puede abrir nuevas vías para innovaciones futuras.
Al reflexionar sobre la energía de ionización, es evidente que su estudio ofrece una ventana para entender mejor el mundo que nos rodea. Te invitamos a seguir investigando este fascinante tema y considerar cómo estos conocimientos pueden ser aplicados a desafíos actuales. No dejes de explorar y cuestionar; cada descubrimiento enriquece nuestra comprensión y nos acerca a soluciones creativas. Comparte tus ideas y participa en conversaciones que impulsen el conocimiento sobre la energía de ionización y sus múltiples aplicaciones.

Deja una respuesta